Rocío es una mujer de 55 años, con alergia a los gatos y dislipemia en tratamiento con atorvastatina, sin ningún otro antecedente personal destacable.
Acude a nuestra consulta refiriendo que tiene una “caspa rebelde” con mucho picor desde hace 6 meses que no mejora con champú anticaspa , “uno que anuncian por la televisión”.
Explica que desde hace varias semanas, también presenta lesiones en axilas que progresan pese a cambio de desodorante o incluso suspender su uso.
Además, expresa la falta de mejoría de las lesiones ungueales por las que consultó hace 3 meses, pese a la aplicación de antifúngico tópico.
Junto a ello, refiere dolor en las articulaciones de la mano izquierda con rigidez matutina que duran más de media hora, dolor de los talones a la deambulación y presencia de un dedo del pie que define “como una salchicha”, sin recordar traumatismo previo.
La paciente fue diagnosticada de psoriasis, una enfermedad inflamatoria, crónica, no infecciosa, incapacitante y de etiopatogenia multifactorial, producto de la interacción entre factores desencadenantes y genéticos individuales. Su prevalencia ronda el 1% de la población general, aunque en España se estima que alcanza el 2,3% de la población, afectando aproximadamente a 1.080.000 personas, sin distinción entre hombres y mujeres.
Es una enfermedad que cursa en brotes, siendo el inicio principalmente en torno a los 20 y a los 55 años de edad.
Suele manifestarse con lesiones cutáneas y/o articulares (psoriasis cutánea) y se asocia a múltiples comorbilidades (obesidad, sd.metabolico, HTA, DM o enfermedad ateroesclerótica); siendo aproximadamente en el 70 % de los casos las manifestaciones cutáneas previas a las articulares.
La psoriasis presenta una etiopatogenia multifactorial propiciada por la interacción entre factores desencadenantes y genéticos.
Se considera una patología mediada inmunológicamente en la que intervienen los linfocitos T, las células dendríticas y diversas citocinas (IL-23, IL-17, TNF). Por esta razón las terapias dirigidas actuarán sobre el eje IL-23/Th17, demostrando ser tan efectivas como otros tratamientos biológicos.
Y a nivel histológico se da una inflamación sostenida que conduce a un descontrol de los queratinocitos por una disfunción en sus procesos de proliferación y diferenciación por lo que los hallazgos clínicos típicos de descamación, induración y eritema serán el resultado de esta hiperproliferación y diferenciación anormal de la epidermis, junto con los infiltrados de células inflamatorias y la dilatación vascular.
Hallazgos típicos a la exploración
El diagnóstico de la psoriasis es eminentemente clínico, a través de la información obtenida en la historia clínica completa (antecedentes, posibles desencadenantes…) y la exploración física, siendo de gran ayuda la aparición de una serie de signos típicos de ésta (aunque algunos no exclusivos):
- Fenómeno de Köebner (también en liquen plano o vitiligo): tras un traumatismo o presión, es posible visualizar en la zona afectada, las lesiones propias de esta dermatosis no aparentes previamente.
- Leucoderma psoriásico: al remitir la lesión psoriásica, a menudo queda una hipocromía residual en la zona en que estuvo esta lesión.
- Halo de Woronoff: halo de piel más pálida que la sana tras resolverse la lesión.
- Signo de Auspitz: se trata de un piqueteado hemorrágico que irrumpe tras el desprendimiento de la membrana de Duncan-Dulckley/placa psoriasica.
Sin embargo, ante las dudas diagnósticas o en ciertos contextos, puede ser preciso realizar pruebas complementarias como:
- Biopsia cutánea con resultado histológico compatible realizando un punch de 4 mm.
- Exámenes de laboratorio: hiperuricemia, líquido de las pústulas (estéril, con infiltración de neutrófilos), cultivo negativo para hongos, etc.
MANIFESTACIONES CUTÁNEAS CARACTERÍSTICAS
La psoriasis se comporta como una enfermedad eritemato-descamativa crónica formada por maculo-pápulas y placas eritemato-escamosas simétricas, no confluyentes, de bordes bien delimitados y con descamación blanca o grisacea, coexistiendo distintas manifestaciones cutáneas incluso dentro de un mismo paciente.
A nivel sintomático, además podrá aparecer prurito junto con dolor por la aparición de fisuras y el tamaño de las lesiones y la persistencia de las mismas es muy variable, pudiendo abarcar desde solo unos meses de evolución hasta continuar en forma de brotes durante toda la vida.
La psoriasis puede aparecer con una gran variedad de formas clínicas y puede mostrar diferentes características según el área corporal afecta.
Formas clínicas de psoriasis
Psoriasis vulgar crónica o en placas / Psoriasis rupiácea (85-90%): suele tener distribución simetrica y en zonas de extensión así como pliegues y las placas serán eritematosas con bordes definidos.
Psoriasis en gotas o guttata: se caracteriza por la aparición abrupta de papulas y placas pequeñas(Diametro <1cm) y múltiples normalmente en tronco y zona distal de extremidades.
Eritrodermia psoriásica: es una manifestación poco común que puede ser aguda o crónica. Se caracteriza por eritema generalizado y descamación en prácticamente toda la superficie corporal produciendo por tanto un aumento del riesgo de infecciones y alteraciones hidroelectroliticas secundarias a la pérdida de líquido.
Psoriasis pustulosa: se caracteriza por la aparición de pústulas estériles de 2-3 mm sobre placas eritematoedematosas. Las pústulas evolucionan de color amarillento a marronáceo y desaparecen en unos 7 días, encontrando en un mismo paciente pústulas en distintos estadios de evolución. A grandes rasgos existen:
o La forma localizada palmo-plantar que puede presentar cuadros con gran afectación de la calidad de vida.
o La forma generalizada (de von Zumbusch) que puede producir malestar general, fiebre, artralgias, edema periférico, uveítis, conjuntivitis, queilitis, pustulosis oral, leucocitosis, diarrea e hipocalcemia.
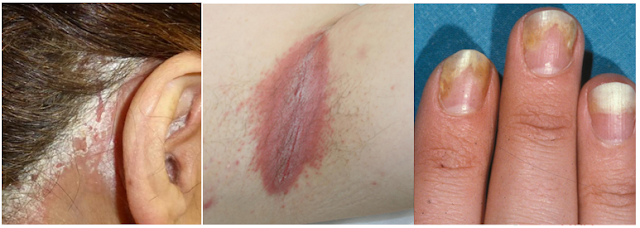
La psoriasis puede presentarse casi en cualquier parte del cuerpo, apareciendo con mayor frecuencia en los codos, las rodillas, el cuero cabelludo, la línea glútea, el ombligo y la espalda, de tal forma que atendiendo a sus ubicaciones especiales podremos encontrar:
⮚ Psoriasis invertida: se refiere a una presentación que incluye zonas intertriginosas como perineal, interglutea, genital, submamaria o axilar así como en zonas de flexión. Es importante distinguirla de las infecciones bacterianas o fúngicas.
⮚
Psoriasis ungueal: el compromiso ungueal se produce más a menudo en los dedos de la mano que en los del pie y puede ocurrir hasta en el 50% de los pacientes. La uña se presenta onicolítica, particularmente piqueteada y con decoloración de color rojo-marrón, asemejándose a gotas de aceite.
⮚ Psoriasis palmoplantar: suele consistir en placas eritematosas e hiperqueratósicas con grietas en esta localización que pueden llegar a ser muy invalidantes.
⮚ Artropatía psoriásica: se presenta en el 10% de pacientes que padecen psoriasis con aparición prematura, concominante o posterior. La afectación articular acostumbra a ser asimétrica con afectación de articulaciones interfalángicas distales y en ocasiones dactilitis.
PRINCIPALES ÍNDICES DE MEDIDA DE GRAVEDAD DE LA PSORIASIS
1. Body Surface Area (BSA)
La forma más sencilla para medir la superficie afectada por las lesiones de psoriasis es usar la palma de la mano del paciente (incluyendo los dedos), como equivalente al 1% de la totalidad de la superficie corporal del mismo. La psoriasis se considera leve cuando afecta menos del 3% de la superficie cutánea, moderada cuando afecta entre el 3 y el 8% y grave cuando afecta más del 10%.
La principal limitación es la dificultad en el cálculo en pacientes con morfología en pequeñas placas o “guttata” y cuando hay zonas de discromía residual que no deben ser consideradas en el cálculo.
2. Psoriasis Area and Severity Index (PASI)
Este índice combina la valoración de cada lesión de psoriasis del 0 al 4 (0=ninguno, 1=leve, 2=moderado, 3=marcado, 4=muy marcado) en base a tres parámetros: eritema, infiltración y descamación, así como una evaluación ponderada del área que afecta dividido el cuerpo en partes, es decir, cabeza, tronco, extremidades superiores y extremidades inferiores.
3. Dermatological Life Quality Index (DLQI)
Este índice es la medida más utilizada para evaluar la calidad de vida del individuo.
Esta medición evalúa el impacto que tuvo la enfermedad en la semana previa y consta de 10 preguntas que cubren seis parámetros: síntomas y sentimientos, actividades diarias, ocio, trabajo o escuela, relaciones personales y molestias con el tratamiento de la enfermedad. Y las opciones se miden desde 0 (no afectado en absoluto) a 3 (muy afectado).
Con este índice se obtiene un rango general de 0 a 30. Por tanto, cuanto más baja sea la puntuación, mejor se considerará la calidad de vida del paciente.
TRATAMIENTO
Por regla general, el tratamiento tópico se administra como primera línea en la psoriasis leve a moderada. Sin embargo, las formas moderada-grave requieren una segunda línea terapéutica que incluye la fototerapia y agentes sistémicos, como la ciclosporina, el metotrexato o la acitretina, fumaratos, apremilast o terapia biológica(Ej:guselkumab que es inhibidor de IL-23 o secukinumab que inhibe IL-17) que suelen asociarse también a tratamiento tópico para el alivio de los síntomas.
El tratamiento de la psoriasis debe ser individualizado según las características del paciente por lo que disponemos de clasificaciones sobre la gravedad de la psoriasis cuyo objetivo es el de facilitar el manejo y la mejor evolución del paciente en cada situación. En este contexto, el Grupo de Psoriasis (GPs) propone considerar candidatos para tratamiento sistémico (y, por lo tanto, también a terapias biológicas) a:
1. Pacientes que cumplen al menos 1 de los siguientes criterios: BSA 10% o PASI > 10 o DLQI > 10.
2. Psoriasis que afecta a áreas expuestas (región facial y dorso de manos), palmas, plantas, genitales, cuero cabelludo, uñas y placas cuando hay impacto funcional o psicológico para el paciente.
3. Psoriasis que no puede controlarse con tratamiento tópico o fototerapia.
Bibliografia
1. Ferrándiz C., et al. Prevalencia de la psoriasis en España en la era de los agentes biológicos. Actas Dermosifiliogr. 2014;105(5):504-509.)
2. Kim WB, Jerome D, Yeung J. Diagnosis and management of psoriasis. Can Fam Physician. 2017;63:278-85.
3. Alfaro Cordero K. Generalidades sobre evaluación de psoriasis. Rev med Costa Rica Centroam. 2015;616:677-80.
4. Bolognia J, Schaffer J, Cerroni L. Dermatología 4.ª Ed. Madrid: Elsevier España; 2018
5. Bielsa I, Ferrrándiz. Dermatología clínica. Madrid: Elsevier; 2019.
6. Elmets CA, Leonardi CL, Davis DMR, et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with awareness and attention to comorbidities. J Am Acad Dermatol 2019; 80:1073.
7. Steven R Feldman, MD, PhD. Psoriasis: Epidemiology, clinical manifestations, and diagnosis review. Sep 12, 2022.
By Inés Cruz Cueva, R2 de Medicina Familiar y Comunitaria en C.S. Gran Vía. Octubre 2023











%20.JPG)
















